 Екатерина Анатольевна КОНДРАТЬЕВА,
Екатерина Анатольевна КОНДРАТЬЕВА,
кандидат медицинских наук,
ведущий научный сотрудник
РНХИ им. А. Л. Поленова,
руководитель группы по изучению
состояния минимального сознания
Цель исследования. Основной целью работы было изучение болевой перцепции у пациентов с хроническим нарушением сознания с помощью индекса анальгезии-ноцицепции (ANI) в вегетативном состоянии/синдроме ареактивного бодрствования и состоянии минимального сознания «плюс» как в состоянии покоя, так и при нанесении болевого стимула.
Методы. В работе проведено изучение информативной значимости системы мониторинга «ANI Metro Doloris» в оценке боли у пациентов с хроническим нарушением сознания. В исследование были включены 9 пациентов в вегетативном состоянии/синдроме ареактивного бодрствования и 20 пациентов в состоянии минимального сознания «плюс». В качестве болевого стимула использовали надавливание на ногтевую фалангу руки неврологическим молоточком. Индекс ANI регистрировали троекратно: в состоянии покоя, после нанесения болевого стимула, а также через 30 минут после нанесения. Также проводили оценку уровня пролактина в крови до и через 10 мин после болевого стимула.
Результаты. При применении робастного двухфакторного дисперсионного анализа выявлено статистически значимое снижение индекса ANI после нанесения болевого стимула и последующее его увеличение независимо от принадлежности к группе (p < 0,0001). Статистически значимых отличий между группами в динамике индекса ANI не выявлено (p = 0,7300).
Заключение. В ответ на болевой стимул у обследованных пациентов получен рефлекторный соматический ответ, который сопровождался снижением индекса ANI на 30% от исходных значений в обеих группах. Можно сделать вывод, что данная методика обладает достаточной чувствительностью в выявлении ноцицепции у пациентов с хроническим нарушением сознания. Динамика изменений индекса ANI в зависимости от формы хронического нарушения сознания — вегетативном состоянии/синдроме ареактивного бодрствования и состоянии минимального сознания «плюс» — требует дальнейших исследований на большей выборке пациентов.
Введение
В последнее время результаты лечения пациентов в остром периоде тяжелого поражения мозга существенно улучшились. Однако снижение летальности привело к возрастанию числа больных с хроническим нарушением сознания (ХНС). Согласно рекомендациям российской экспертной группы, нарушение сознания считают хроническим, если не происходит его полного восстановления в период более 4 недель от момента повреждения мозга [1]. К основным вариантам ХНС относят вегетативное состояние/синдром ареактивного бодрствования (ВС/САБ) и состояние минимального сознания (СМС) [2].
ВС/САБ характеризует сохранность реакции бодрствования (открывания глаз) без признаков осознания себя и окружающих. Пациенты в СМС проявляют первые признаки сознания: для СМС «минус» характерны только слежение и фиксация взора, без выполнения простых заданий, а при СМС «плюс» возможен ответ на вопросы «да»/«нет» (как речевой, так и невербальный), артикуляция или попытки к речевой продукции, эмоциональная или целенаправленная моторная активность [1, 2]. Особенность восприятия афферентных сигналов, в том числе и болевых — является одной из фундаментальных научных проблем у пациентов с ХНС.
Исследования, в которых применяли функциональный режим МРТ (фМРТ), позитронно-эмиссионную томографию с 18-фтордезоксиглюкозой (18-ФДГ ПЭТ), оценку воздействия лазерного стимула с помощью многоканальной электроэнцефалографии (ЭЭГ) и другие методы, показали, что восприятие болевого стимула (БС) увеличивается по мере расширения сознания [3–5]. Паттерн активации соответствующих мозговых структур в ответ на БС у пациентов в СМС был ближе к результатам, полученным на здоровых добровольцах [6]. При применении фМРТ выявлена большая функциональная взаимосвязь в структурах так называемой «матрицы боли» у пациентов в СМС по сравнению с пациентами в ВС/САБ. A. Mouraux с соавт. предложили по различиям изменений 18-ФДГ ПЭТ в ответ на БС дифференцировать ВС/САБ и СМС [7]. Применение нейрофизиологических методик в оценке ответных реакций на БС у пациентов с ХНС показало, что у пациентов в СМС сохранялась реакция ЭЭГ на лазерные, холодовые, вибротактильные стимулы, в то время как у пациентов в ВС/САБ такие изменения на ЭЭГ отсутствовали [8, 9].
В основе адекватной интерпретации результатов, полученных любым методом, лежит возможность различать вегетативные реакции на неприятные раздражители и осознанное переживание боли [10, 11], что представляет значительные трудности, так как выявить степень остаточного функционирования и взаимосвязи различных отделов коры головного мозга, необходимые для соматосенсорного и когнитивного восприятия боли, непросто [12, 13]. Возможно, у пациентов с ХНС мы наблюдаем диссоциацию между ощущением боли и непосредственно ноцицепцией, так как боль считают субъективным когнитивным процессом, для реализации которого необходима активность коры головного мозга [14].
Таким образом, изучение восприятия боли у этой категории пациентов является уникальной «моделью» исследования взаимосвязи афферентного болевого сигнала и сознания. Однако для практического применения необходим надежный и удобный в применении метод оценки болезненных ощущений у пациентов с ХНС. Известно, что у данной категории пациентов постоянно присутствует множество патологических процессов, которые при сохранном сознании однозначно являются афферентными сигналами боли: спастичность, контрактуры, гетеротопическая оссификация, полинейромиопатия [15, 16]. В настоящее время наибольшее распространение получила шкала оценки боли у пациентов в коме — Nociception Coma Scale — Revised (NCS–R) [17], которая изначально разрабатывалась для новорожденных и пациентов с тяжелой формой деменции, а затем была адаптирована для пациентов с ХНС. Шкала включает оценку двигательного, вербального и эмоционального ответов на боль. Согласно исследованиям, проведенным у пациентов с ХНС, при суммарном балле < 2 поведенческий паттерн не связан с БС, а значение ≥ 5 подтверждает наличие коркового компонента в ответ на БС и сохранность так называемого нейронального «матрикса боли» [18]. Наблюдающиеся у большинства больных с ХНС двигательные нарушения, стереотипные примитивные негативные эмоции, возникающие спонтанно, без видимых стимулов (гримаса недовольства, плач), могут привести к неправильной интерпретации ответной реакций по шкале NCS–R. Наличие трахеостомы влияет на результат, но все же позволяет использовать шкалу [19].
Из вышесказанного следует, что в комплексной реакции на БС у больных с ХНС всегда будет преобладать вегетативный компонент. По-видимому, комплексный анализ вегетативных реакций способен уловить и корковый компонент, если таковой присутствует. Одним из методов верификации боли является оценка вариабельности сердечного ритма. На этой основе построена методика оценки болевого синдрома в мониторе «ANI Metro Doloris», который в настоящее время широко используют в анестезиологии. Прибор позволяет интерпретировать уровень боли пациента в числовом показателе. Значения индекса ANI от 50 до 70 соответствуют адекватному обезболиванию, ниже 50 — неадекватному обезболиваю и умеренной боли, ниже 30 — сильной боли [20]. Д. М. Пасичнюк и соавт. использовали монитор ANI для оценки болезненных ощущений у пациентов с ХНС при проведении реабилитационных мероприятий. Снижение индекса ниже 50 во время выполнения лечебной процедуры означало необходимость использования анальгетиков и коррекции объема реабилитационных мероприятий [21].
Основной целью работы было изучении болевой перцепции у пациентов с ХНС с помощью индекса анальгезии–ноцицепции (ANI) у пациентов в ВС/САБ и СМС «плюс» как в состоянии покоя, так и при нанесении БС.
Материалы и методы
Исследование одобрено этическим комитетом ФГБУ НМИЦ им. В. А. Алмазова (выписка № 23082019 заседание № 08-19 от 12.08.2019 г).
В исследование были включены 29 пациентов с ХНС. Возраст пациентов составил от 22 до 56 лет (средний возраст — 34,75 ± 11,54), мужчин — 22. Средняя продолжительность нарушения сознания — 21 месяц. Этиология поражения головного мозга: последствия ЧМТ — 19 пациентов (18 в СМС «плюс», 1 в ВС/САБ), последствия гипоксии — 6 пациентов (ВС/САБ), другие причины нетравматического поражения мозга 4 пациента (2 — СМС «плюс», 2 — ВС/САБ). В исследование не включали пациентов, получавших препараты, влияющих на частоту сердечных сокращений, а также пациентов с нарушением сердечного ритма. После пятикратной оценки по шкале восстановления после комы (шкале CRS–R) [22] у 9 пациентов диагностировано ВС/САБ — они отнесены в первую группу (средний балл по шкале CRS–R составил 5 ± 1,4), у 20 пациентов уровень сознания соответствовал СМС «плюс», они отнесены во вторую группу (средний балл по шкале CRS–R составил 10,45 ± 4,5). В качестве БС использовали надавливание на ногтевую фалангу руки неврологическим молоточком. Индекс ANI регистрировали трехкратно (система мониторинга «ANI Monitor» для анестезиологии, реанимации, регистрационное удостоверение от 15.09.2014 г): в состоянии покоя, после нанесения БС, а также через 30 минут после нанесения БС (рис. 1).
Также проводили оценку уровня пролактина в крови до и через 10 минут после нанесения БС. В связи с тем, что традиционные «гормоны стресса», в том числе кортизол являются частью вегетативного ответа на боль, выбран пролактин, так как, возможно, динамика его секреции на стрессорные раздражители требует участия коркового компонента. Кровь отбирали в пробирки с активатором свертывания для получения сыворотки, после центрифугирования образцы замораживали до проведения анализа. Концентрацию пролактина измеряли на иммунохемилюминесцентном анализаторе Immulite 1000, DPC (США) с помощью наборов производителя Siemens Healthcare Diagnostics Products Ltd (Великобритания).
Оценку по шкале NCS–R выполняли однократно во время нанесения БС.
Анализ полученных результатов проводили с использованием среды для статистических вычислений R 3.5.3 (R Foundation for Statistical Computing, Вена, Австрия) с использованием дополнительных пакетов сторонних разработчиков (WRS2 1.0.0, PMCMRplus 1.4.2). Описательные статистики для количественных переменных представлены в виде медианы (1-й и 3-й квартили). Для анализа ассоциации индекса ANI и уровня пролактина с вариантом ХНС использовали робастный двухфакторный дисперсионный анализ [23, 24]. Для сравнения количественных переменных в двух группах использовался тест Манна–Уитни. Для сравнения динамики количественных переменных использовались тест Фридмана (тест Коновера использовался в качестве post hoc [25] и тест Уилкоксона. Для оценки корреляции между количественными переменными применялся коэффициент ранговой корреляции ρ Спирмена. Различия между группами и корреляции между количественными переменными считали статистически значимыми при p < 0,05.
Результаты исследования и их обсуждение
Результаты изменений индекса ANI до, во время и после нанесения БС, а также суммарный балл по шкале NCS–R и динамика секреции пролактина представлены в таблице.
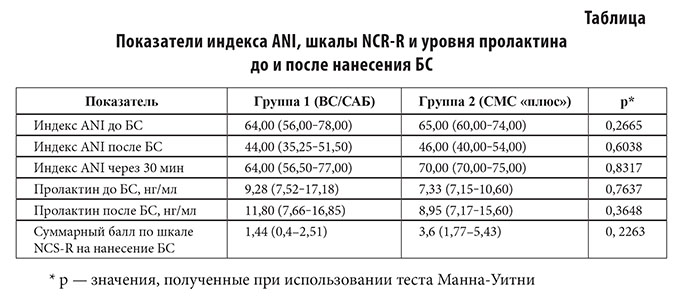
Референсные значения уровня пролактина: мужчины: 2,5–17,0 нг/мл; женщины 4,5–46,0 нг/мл.
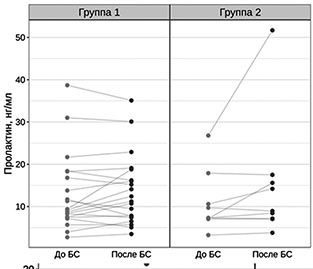
При применении робастного двухфакторного дисперсионного анализа выявлено статистически значимое снижение индекса ANI после нанесения БС и последующее его увеличение независимо от принадлежности к группе (p < 0,0001) (рисунок 2). Статистически значимых отличий между группами в динамике индекса ANI не выявлено (p = 0,7300). Уровни пролактина у пациентов 1 и 2 группы до и после нанесения БС оставались в пределах референсных значений (V = 83,5; p = 0,433 и V = 7; p = 0,1415 соответственно) (рис. 2, 3).
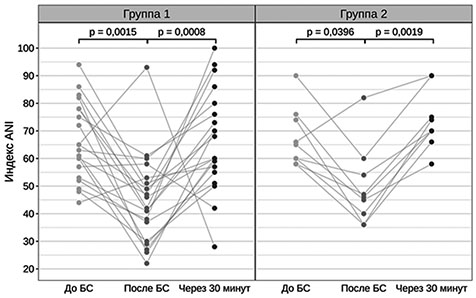
| Рис. 2. Динамика изменения индекса ANI до, во время и после БС в обследуемых группах |
Рис. 3. Динамика уровня пролактина до и после нанесения БС в обследуемых группах |
Примечание: представленные на рисунке p-значения получены с использованием теста Коновера при попарных post hoc сравнениях (результаты теста Фридмана для группы 1: F = 13,9, p < 0,0001; для группы 2: F = 16,98, p = 0,0001).
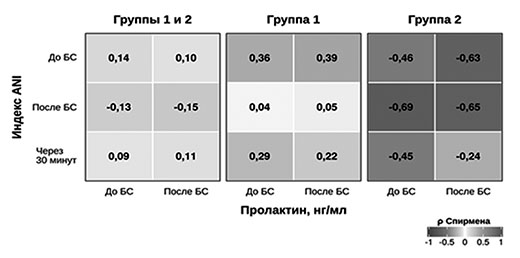
значений индекса ANI и уровня пролактина (во всех случаях p >0,05)
Разнонаправленный паттерн попарных корреляций между значениями индекса ANI и уровнем пролактина в крови до и после нанесения БС показан на рисунке 4, демонстрирующем отрицательную корреляцию данных показателей у пациентов в СМС «плюс» (2 группа) и положительную корреляцию у пациентов в ВС/САБ (1 группа).
Таким образом, получена сходная динамика изменения индекса ANI в ответ на БС у пациентов в СМС «плюс» и ВС/САБ. У всех пациентов независимо от уровня сознания значение исходного индекса ANI было выше 55, что, по-видимому, свидетельствует об отсутствии выраженных вегетативных реакций, свидетельствующих о наличии болезных ощущений в состоянии покоя. В ответ на нанесение БС разница в значениях индекса ANI у пациентов в ВС/САБ и СМС «плюс» была статистически незначима. Учитывая, что выбранный БС — надавливание молоточном на фалангу пальца — не вызывает сильных болевых ощущений, правомочно отметить, что в данной работе мы проводили исследование ноцицепции, а не боли. Возможность с помощью индекса анальгезии–ноцицепции выявлять у пациентов с ХНС не только болезненные, но и неприятные стимулы важна для определения чувствительности методики при использовании во время реабилитационных мероприятий (лечения спастичности и контрактур и др.).
В ответ на БС у обследованных пациентов получен рефлекторный соматический ответ, который сопровождался снижением индекса ANI на 30% от исходных значений в обеих группах. Можно сделать вывод, что данная методика обладает достаточной чувствительностью в выявлении ноцицепции у пациентов с ХНС. Динамика изменений индекса ANI в зависимости от формы ХНС — СМС «плюс» или ВС/САБ — требует дальнейших исследований на большей выборке пациентов. У пациентов в СМС «плюс» уровень пролактина увеличивался в ответ на БС, что не наблюдалось у пациентов в ВС/САБ. Наиболее отчетливые различия в реакции на БС у пациентов в ВС/САБ (группа 1) и СМС «плюс» (группа 2) получены по результатам оценки по шкале NCS-R. Можно предположить, что данная шкала охватывает более широкий спектр нейрональных связей в сравнении методикой определения индекса анальгезии-ноцицепции.
Заключение
В настоящее время оценка интенсивности боли у пациентов с ХНС ограничена сложностью объективизации коркового компонента в структуре ответа на БС у больных с нарушением сознания. Сохраняется масса противоречий в результатах исследований восприятия афферентных сигналов, в том числе ноцицептивных, больными в ВС/САБ и СМС. Достаточно ли у пациента с ХНС стабилизировать сопутствующие боли вегетативные показатели, полагая, что у них не может быть болевых ощущений? Получить ответы на эти вопросы, по-видимому, можно только в контексте изучения особенностей функционирования центральной нервной системы у этой весьма неоднородной категории больных. В рекомендациях Американской академии неврологии подчеркивается, что «врачи должны оценивать признаки болевого синдрома у пациентов с ХНС, и в случае их наличия проводить соответствующее лечение, независимо от уровня сознания» [26]. Можно предположить, что проведение дальнейших исследований, в том числе с применением системы мониторинга «ANI Metro Doloris» в оценки боли у пациентов с ХНС позволит выработать критерии для объективной оценки ноцицептивной импульсации и выбора адекватных схем обезболивания, например, при ранней реабилитации.
Работа выполнена при поддержке гранта РФФИ 19-29-01066.
Литература
1. Пирадов М. А., Супонева Н. А., Вознюк И. А., Кондратьев А. Н. и др. Хронические нарушения сознания: терминология и диагностические критерии. Результаты первого заседания Российской рабочей группы по проблемам хронических нарушений сознания // Анналы клинической и экспериментальной неврологии. 2020. Т. 14. № 1. С. 5–16. doi: 10.25692/ACEN.2020.1.1.
2. Kondziella D., Bender A., Diserens K. et al. European Academy of Neurology guideline on the diagnosis of coma and other disorders of consciousness // Europe Journal Neurology. 2020. V. 27(5). P. 741–756. doi: 10.1111/ene.14151.
3. Laureys S., Faymonville M. E., Peigneux P., Damas P., Lambermont B., Del Fiore G. et al. Cortical processing of noxious somatosensory stimuli in the persistent vegetative state // NeuroImage. 2002. V. 17(2). P. 732–741. PMID: 12377148.
4. Kassubek J., Juengling F. D., Els T., Spreer J., Herpers M., Krause T. et al. Activation of a residual cortical network during painful stimulation in long-term postanoxic vegetative state: a 15O–H2O PET study // Journal of the Neurological Sciences. 2003. V. 212(1–2). P. 85–91. doi: 10.1016/s0022-510x(03)00106-0.
5. Boly M., Faymonville M. E., Schnakers C., Peigneux P., Lambermont B., Phillips C. et al. Perception of pain in the minimally conscious state with PET activation: An observational study // The Lancet. Neurology. 2008. V. 7(11). P. 1013–1020. doi: 10.1016/S1474-4422(08)70219-9.
6. Boly M., Faymonville M. E., Peigneux P. Cerebral processing of auditory and noxious stimuli in severely brain injured patients: Differences between VS and MCS // Neuropsychology Rehabilition. 2005.V. 15(3–4). P. 283–289. doi: 10.1080/09602010443000371.
7. Mouraux A. The cortical processing of pain // Assessing Pain and Communication in Disorders of Consciousness / Ed. by C. Chatelle, S. Laureys. Routledge, 2015. P. 12–42.
8. Mulders D., de Bodt C., Lejeune N., Courtin A., Liberati G., Verleysen M. et al. Dynamics of the perception and EEG signals triggered by tonic warm and cool stimulation // PLoS One. 2020. V. 15(4). P. e0231698. doi: 10.1371/journal.pone.0231698.
9. Lejeune N., Mouraux A. Investiguer la relation entre douleur et conscience: une approche lésionnelle au moyen de l’électroencéphalographie // Douleur et Analgésie. 2019. V. 32(1). P. 69–70. doi: 10.3166/dea-2019-0054.
10. Chatelle C., Thibaut A., Whyte J., De Val M. D., Laureys S., Schnakers C. Pain issues in disorders of consciousness // Brain Injure. 2014. V. 28(9). P. 1202–1208. doi: 10.3109/02699052.2014.920518.
11. Kotchoubey B. Patients with unresponsive wakefulness syndrome respond to the pain cries of other people //Neurology. 2013. V. 80(4). P. 345–352. doi: 10.1212/WNL.0b013e31827f0846.
12. Flor H., Nikolajsen L., Staehelin Jensen T. Phantom limb pain: A case of maladaptive CNS plasticity? // Nature Reviews. Neuroscience. 2006. V. 7(11). P. 873–881. doi: 10.1038/nrn1991.
13. Hofbauer Robert K., Fiset P., Plourde G., Backman S. B., Bushnell M. C. Dose-dependent effects of propofol on the central processing of thermal pain // Anesthesiology. 2004. V. 100(2). P. 386–394. doi: 10.1097/00000542-200402000-00031.
14. Treede R. D., Kenshalo D. R., Gracely R. H., Jones A. K. The cortical representation of pain // Pain. 1999. V. 79(2–3). P. 105–111. doi: 10.1016/s0304-3959(98)00184-5.
15. Ganesh S., Guernon A., Chalcraft L., Harton B.. Smith B., Louise-Bender Pape T. Medical comorbidities in disorders of consciousness patients and their association with functional outcomes // Archives of Physical Medicine and Rehabilitation. 2013. V. 94(10). P. 1899–1907. doi: 10.1016/j.apmr.2012.12.026.
16. Whyte J., Nordenbo A. M., Kalmar K., Merges B., Bagiella E., Chang H. et al. Medical complications during inpatient rehabilitation among patients with traumatic disorders of consciousness // Archives of Physical Medicine and Rehabilitation. 2013. V. 94(10). P. 1877–1883. doi: 10.1016/j.apmr.2012.12.027.
17. Bagnato S., Boccagni C., Sant’Angelo A., Alito A., Galardi G. Pain assessment with the revised nociception coma scale and outcomes of patients with unresponsive wakefulness syndrome: Results from a pilot study // Neurological Sciences. 2018. V. 39(6). P. 1073–1077. doi: 10.1007/s10072-018-3330-5.
18. Bonin E. A., Lejeune N., Thibaut A., Cassol H., Antonopoulos G., Wannez S. et al. Nociception Coma Scale–Revised allows to identify patients with preserved neural basis for pain experience // The Journal of Pain. 2019. V. 21(5–6). P. 742–750. doi: 10.1016/j.jpain.2019.11.004.
19. Lejeune N., Thibaut A., Martens G., Martial C., Wannez S., Laureys S. et al. Can the Nociception Coma Scale–Revised be used in patients with a tracheostomy? // Archives of physical medicine and rehabilitation. 2019. V. 101(6). P. 1064–1067. doi: 10.1016/j.apmr.2019.09.020.
20. Спасова А. П., Тихова Г. П., Базаров Р. О. Индекс анальгезии–ноцицепции: возможности и пределы // Вестник анестезиологии и реаниматологии. 2015. Т. 12. № 5. С. 64–70.
21. Способ индивидуальной коррекции терапии пациентов с длительным нарушением сознания: патент 2715981 Рос. Федерация. № 2019108526 / Пасичнюк Д. М., Умаева М. А., Соболев М. А.; заявл. 25.03.2019; опубл. 04.03.2020. Бюл. № 7. 11 с. URL: https://findpatent.ru/patent/271/2715981.html (дата обращения: 25.10.2021).
22. Мочалова E. Г., Легостаева Л. A., Зимин A. A. Русскоязычная версия пересмотренной Шкалы восстановления после комы (Coma Recovery Scale–Revised) — стандартизированный метод оценки пациентов с хроническими нарушениями сознания // Журнал неврологии и психиатрии им. С. С. Корсакова. 2018. Т. 118(2–3). С. 25–31. doi: 10.17116/jnevro20181183225-31.
23. Mair P., Wilcox R. Robust statistical methods in R using the WRS2 package // Behavioural Brain Research. 2019. № 52. P. 464–488. doi: 10.3758/s13428-019-01246-w.
24. Wilcox R. Introduction to Robust Estimation and Hypothesis Testing. 4th ed. Elsevier, 2017.
25. Conover W. J., Iman R. L. On multiple-comparisons procedures. Tech. Rep. LA-7677-MS. Los Alamos: Los Alamos Scientific Laboratory, 1979.
26. Giacino J. T., Katz D. I., Schiff N. D. et al. Practice guideline update recommendations summary: disorders of consciousness: report of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology; the American Congress of Rehabilitation Medicine; and the National Institute on Disability, Independent Living, and Rehabilitation Research // Neurology. 2018. V. 91(10). P. 450–460. doi: 10.1212/WNL.0000000000005926.



