 Александр Григоьевич ЧУЧАЛИН,
Александр Григоьевич ЧУЧАЛИН,
академик РАН, профессор,
заведующий кафедрой госпитальной терапии
Российского национального исследовательского
медицинского университета
им. Н. И. Пирогова
Одним из вопросов первостепенного значения, к которому в данный момент приковано внимание мирового медицинского сообщества, являются продолжительные симптомы заболевания у пациентов, перенесших новую коронавирусную инфекцию. Крайне важны патофизиологические изменения, происходящие в постковидном периоде, когда уже завершился период вирусемии. У людей, переболевших COVID-19, проявляются различные клинические синдромы:
- признаки изменения в тех или иных органах, приводящие к развитию их дисфункции (сердце, легкие, мозг, печень, почки и др.);
- признаки нарушения ментальной деятельности (нарушение настроения, депрессия, ухудшение сна) и когнитивных функций (например, ухудшение памяти);
- развитие фиброзов легких.Рис. 11. Сладжи, образованные эритроцитами [8]
Публикации данных в отношении пациентов, переболевших COID-19 1,5–2 года назад, демонстрируют остроту этих проблем.
За последние два года в трактовке COVID-19 открылись новые горизонты, известна геномная структура вируса и многое другое. Но в отношении предупреждения заболевания и его эффективного лечения многое неясно. Особенно много вопросов вызывают фиброзные изменения. Как и почему они возникают у человека?
Легочная ткань — воздушная, легкая, но при ковидной инфекции вдруг мгновенно происходят ее изменения, как будто снежная буря налетает на эту легочную ткань, и в течении короткого времени состояние больного человека становится критическим. Происходят драматические явления, называемые в научной медицинской литературе ремодулированием легочной ткани. Изменяется структура альвеол, местоположение бронхов, происходят большие изменения со стороны сосудов. В процесс вовлекается сердечно-сосудистая система, в организме происходят глобальные изменения, которые человека делают критически, очень тяжело больным.
Проблема постковидного периода очень острая. Британские исследователи изучили данные около 48 000 пациентов, госпитализированных с COVID-19, сопоставив их с контрольной группой из общего населения Англии. Они обнаружили, что у пациентов с COVID-19 после выписки из больницы диагностировались чаще серьезные сердечно-сосудистые осложнения, хронические заболевания почек в 2,8 раза, хронические заболевания печени в 1,9 раза и диабет в 1,5 раза чаще в сравнении с населением в целом. Около 29% пациентов с COVID были повторно госпитализированы со средним сроком наблюдения 140 дней, и около 12% умерли после выписки. Эти показатели были в 3,5 раза и 7,7 раза выше, чем в контрольной группе, соответственно [1].
Инкубационный период заболевания в самом начале распространения COVID-19 в декабре 2019 г., в Ухани составлял 9–10 дней. Затем появились новые штаммы, инкубационный период сокращался. В настоящий момент эпидемическая ситуация связана со штаммами Omicron и Stealth. Приходит вариант Omicron, который классифицируется как ВА3, а на пороге уже субвариант, пока редкий, получивший название BF.7.
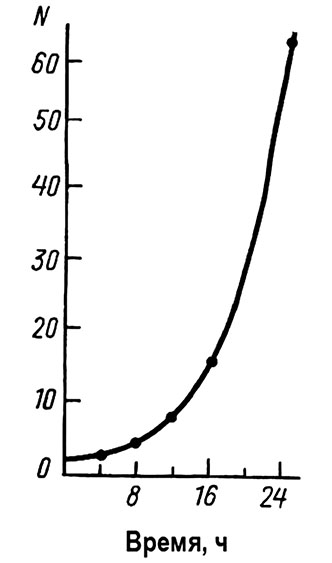
популяции гипотетического
одноклеточного организма,
делящегося каждые 4 часа
Инкубационный период COVID-19 связан с репликацией вируса на поверхности слизистой носа, которая играет очень важную роль, являясь пусковым механизмом последующих событий, разыгрывающихся в организме человека. Во время инкубационного периода (в одном случае это 9–10 дней, в другом случае 6 часов), происходят драматические изменения. Происходит бурная репликация вируса, которая напоминает, если можно провести такую аналогию, ядерный взрыв — экспоненциальный рост вирусных частиц, которые находятся на слизистой носа.
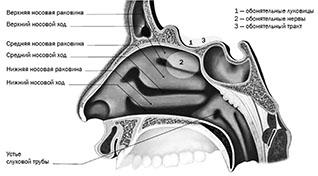
Каковы причины подобного роста? Согласно концепции академика С. Д. Варфоломеева, условием является изменение локального водородного показателя рН среды, который становится кислым, принимая значения 7,3–7,35 и т. д. [3]. Происходит ингибиция карбонгидразы, то есть создаются физико-химические условия для того, чтобы образовались вирусные частицы — агломераты, поражающие различные ткани и системы, например нейроэпителий (рис. 3). При штаммах вируса SARS-CoV-2, предшествующих Omicron, очень выражены были поражения nevus olfhactorius и некоторых других черепно-мозговых нервов. Но наиболее серьезные проблемы начинаются, когда коронавирус (пандемические штаммы) проникает в нижние отделы дыхательных путей и атакует клетки, альвеолоциты 2-го типа, регулирующие водно-электролитный обмен в легочной ткани. Это критический момент заболевания, начинается процесс, который приобретает драматический характер и может стать причиной ухода человека из жизни.
На рисунке 4 показаны разыгрывающиеся в организме молекулярно-биологические процессы. Альвеолоциты 2-го типа, обозначеные клетками АТ2, поражаются, пролиферируются, превращаются в альвеолоциты 1-го типа, нарушается синтез сурфактанта, и поражаются так называемые водные каналы, жидкость из плазмы, из капилляров, проникает и заполняет альвеолярные пространства. Резко нарушается водно-электролитный обмен, вода буквально наполняет легкое — развивается некардиогенный отек.
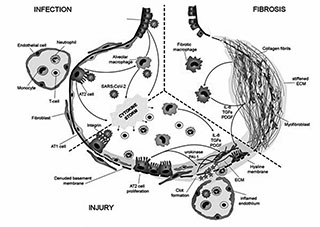
| Рис. 3. Поражение вирусом SARS-CoV-2 нейроэпителия [4] | Рис. 4. COVID‐19 и легочный фиброз: потенциальная роль эпителиальных клеток легких и фибробластов [5] |
На правой части рисунка можно видеть, как определенный род макрофагов (в данном случае 2-го типа), приводит к активности интерлейкин 6, являющийся трансформирующим фактором роста ткани, фактором роста тромбоцитов. Интерлейкин 6 может играть решающую роль в развитии фиброзных изменений в легких пациентов с COVID-19. В этом заключается биологическая причина пролиферации фибробластов. Образуются миофибробласты, в большом количестве коллаген I, III типов, и легочная ткань превращается в ткань, напоминающую жженную резину. Она становится маленькой, сморщенной, теряет способность выполнять главную функцию легких — обеспечение газообмена.
Это первый этап — диффузные повреждения альвеолоцитов 2-го типа и выход из интерстициального пространства гиалуроновой кислоты. Гиалуроновая кислота имеет большое значение в формировании так называемых гиалиновых мембран, что является признаком респираторного дистресс-синдрома. Можно сказать, что гиалуроновая кислота — биологический маркер острого повреждения легких и развития острого респираторного дистресс-синдрома, затяжного течения COVID-19, развития постковидного синдрома.
Снежное облако, упоминавшееся вначале, — отражение диффузных повреждений легочной ткани с депонированием гиалуроновой кислоты и реомодерированием альвеолокапиллярной мембраны.
Большое значение имеет соотношение между гиалуроновой кислотой и ферментом гиалуронидазой, дисбаланс между ними характерен для острых состояний. Гиалуронидазе принадлежит ключевая роль в борьбе с гипоксемией, она обеспечивает доставку кислорода в капилляры из альвеолярного пространства.
Науке не известно ни одного заболевания, при котором за короткий промежуток времени в легком накапливалось бы такое большое количество воды, как при СOVID-19. Когда патологоанатомы впервые увидели фото, показанное на рисунке 5, они были не могли понять, какой это орган, напоминающий печень, глиссонову капсулу. А это легкое, потерявшее альвеолярную поверхность. К таким серьезным ремоделирующим изменениям приводит упомянутая ранее атака.
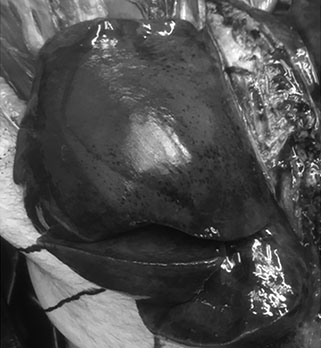
COVID-19: патобиология Вес легкого умершего от коронавирусного заболевания составил 2 404 г. Вес легкого умершего не от коронавирусного заболевания составил 1 045 г. |
На ишимизированных участках легочной ткани, где нет капилляров, куда не поступает кровь, в дальнейшем появляются блистеры — воздушные пузыри, в результате чего развивается острая буллезная болезнь легких.
бронхиол и альвеол
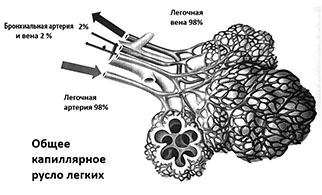
Изменения, которые происходят в легких в постковидный период, связаны с капиллярами. Капилляры каждого органа (мозг, сердце, легкие, печень, кожа) имеют свою неповторимую структуру. Альвеолярные капилляры, где осуществляется газообменная функция, не встречаются более ни в каком другом органе. Особое значение имеет участок капилляра — «колено», переходящий в венулу. Именно это место является первичным в тромбообразовании — тромбы образуются в альвеолярных капиллярах, на участке перехода «колена» в венулу. В этом месте эндотелиоциты продуцируют определенные факторы-прокоагулянты и антикоагулянты. Чтобы понять, как именно это происходит в организме человека, необходимо обратиться к некоторым базовым вопросам.
Диффузия газов — это движение молекул из области с высокой концентрацией в область с более низкой концентрацией. Кислород на поверхности альвеол, и кислород, находящийся в крови, за счет градиента концентрации диффундирует в легочную ткань.
|
Факторы, влияющие на диффузию газов: 1) температура — повышает скорость движения молекул, 2) площадь биологической мембраны, через которую осуществляется диффузия, 3) градиент концентрации газа на поверхности мембраны, где осуществляется диффузия, 4) расстояние, которое необходимо преодолеть молекуле, 5) молекулярный вес.
|
Для диффузии газов большое значение имеет температура, так как при повышении температуры скорость движения молекул резко возрастает. Большое значение имеет площадь биологической мембраны. Легочная площадь биологических мембран превышает 120 м2.
Для создания условий для хорошей диффузии кислорода в легочную ткань нами применялся термический гелий [6]. Благодаря высокой диффузионной способности гелия при применении смеси термический гелий–кислород (t-He/O2) улучшаются газообменная функция, показатели парциального напряжения кислорода, возрастают сатурация крови, увеличивается элиминация углекислого газа. Кроме того, при терапии смесью t-He/O2 ожидается снижение анаэробной фазы метаболизма и нормализация концентрации лактата, который накапливается в результате гиперперфузии и тканевой ишемии вследствие гипоксемии, приводящей к гипоксии ткани. Терапия термическим гелем позволяет эффективно элиминировать лактат из организма пациента. Предложенный метод — действительно реальное активное внедрение в метаболизм организма человека.
Также для помощи больному человеку мы рекомендуем ему принимать положение, которое называется прон-позиция. Так как диффузия газов осуществляется той частью легких, которая приходится на базальную зону, придав больному пром-позицию, мы увеличиваем вентиляцию легких и перфузию тем самым на 2–3%, что повышаете сатурацию кислорода. Сейчас многие врачи прибегают к этому приему, его применяют даже акушеры при рождении ребенка: для того чтобы у него не было асфиксии, его кладут на живот для обеспечения эффективной вентиляции, эффективной перфузии, коэффициент которой составляет 0,8.
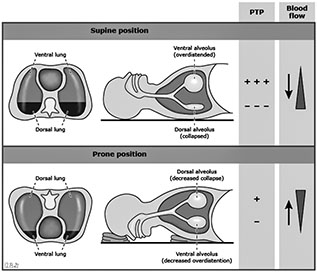
| Рис. 7. Использование прон-позиции при лечении COVID-19 | Рис. 8. Микрососудистые изменения в легких у пациентов, умерших от COVID-19 [7] |
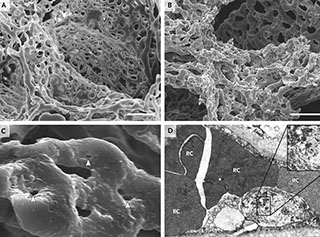
На рисунке 8 представлены уникальные снимки, полученные группой ученых вместе с доктором T. Welte из Ганновера [7]. На них показано разрушение эндотелиальных клеток, которые играют важную роль в регуляции движения крови по капиллярам, в регуляции вязкости, тромбообразования и др. Эндотелиоцит считывает информацию, которая происходит при его контакте с форменными элементами крови. Так как эндотелий потерял свою функцию, в ответ на это в месте, упоминаемом ранее (капилляр–венула) образуется тромб. Такой капилляр не может обеспечить газообменную функцию, но включаются другие капилляры, идет их активное открытие, открываются анастомозы, поэтому происходит частичная компенсация. Но клетки меняются, так как эндотелиоцит выключен из процесса, это приводит к появлению мегакариоцитов больших размеров. Существуют математические модели, показывающие, что, измеряя размеры тромбоцитов — мегакариоцитов, можно прогнозировать тяжелое течении заболевания.
перегородках легкого у пациента,
умершего от Covid-19 [7]
В работе M. Ackermann [7], одной из первых на данную тему, хорошо показано образование тромбов в альвеолярной перегородке (рис. 9). На снимке можно видеть слегка расширенные альвеолярные стенки с множественными фибринозными микротромбами (показанными стрелками) в альвеолярных капиллярах. С мегакариоцитами мелких сосудов капилляров мозга связаны изменения, впоследствии вызывающие депрессию, нарушение структуры сна, снижение толерантности к физической нагрузке. Морфологическая причина этих явлений — нейровоспалительный процесс, повреждение эндотелия в конечном счете.
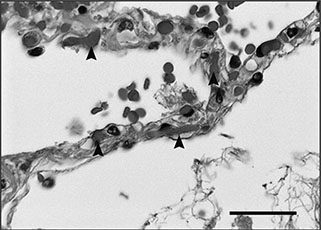
Группа российских исследователей целенаправленно занималась оценкой функций эндотелия и функцией эритроцитов [8], и на мой взгляд это лучшее исследование, которое было сделано по данной теме в России. Оно открывает картину изменений в сосудах больных в случае постковидного синдрома.
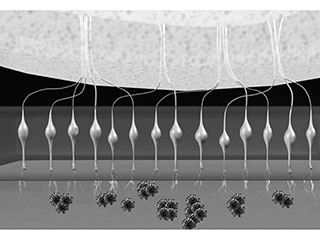
На рисунке 10 показаны снимки, изображающие эндотелиальные клетки пациента с COVID-19. Мы можем видеть в них пробоины, окна, фенестры в тех местах, через которые геном вируса вошел в эндотелиоцит и вышел. То есть каждая вирусная частица оставляет две пробоины в биологической мембране эндотелиоцита. Клетка, которая осталась без ядра, — это мертвая клетка. В норме в организме их содержится около 1%. У больных, которые переносят ковид, количество таких клеток возрастает до 20–30%. То есть у таких больных происходит гибель 30% эндотелиоцитов. Мертвые клетки вызывают образование сгустков крови.
Вторая проблема связана с потерей функции эндотелиоцитов, эритроциты складываются в монетные столбики — сладжи (рис. 11). Большое количество эритроцитов, сложившихся вместе, не может двигаться по кровеносному руслу. Они блокируют капиллярное кровообращение у таких больных. Согласно данным упомянутого исследования у пациентов с COVID-19 изменения с эритроцитами проявлялись прежде всего в образовании длинных эритроцитарных монетных столбиков, сладжей, и трансформацией формы эритроцитов, часть из которых превращалась из двояковогнутых дискоцитов в эхиноциты.

Рис. 10. Эндотелиоциты в крови, взятой
из кубитальной вены больного COVID-19 [8]

Рис. 11. Сладжи, образованные эритроцитами [8]

больных COVID-19 [8]
Морфология эритроцитов в результате воздействия вирусов меняется поразительным образом, их невозможно узнать. На рисунке 12 представлено фото эхиноцита, образовавшегося из эритроцита, поврежденного вирусом, в крови пациента с COVID-19. Исследователи наблюдали выраженную трансформацию части эритроцитов в эхиноциты в крови больных COVID-19 как при поступлении в больницу, так и при выписке.
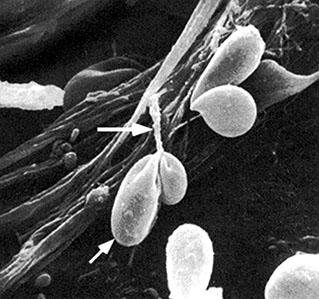
который скоро будет «перерезан» нитью
фибрина (показана верхней стрелкой),
образующейся в результате внутрисосудистого
свертывания [9]
Изменения, происходящие в крови пациента с новой коронавирусной инфекцией, очень похожи на те, что происходят в крови больного с тяжелым почечным заболеванием — уремией. Визуально отличить периферическую кровь при этих разных заболеваниях невозможно. Однако при автоматическом машинном анализе эти особенности нередко ускользают от внимания специалистов. На рисунке 13 показано уникальное фото, демонстрирующее процесс образования тромба. Плотная полоса фибрина на заднем плане снимка образовалась из скоплений более тонких нитей. Выпадение фибрина происходит вследствие агрегирования эритроцитов, теряющих эндотелиальную функцию.
Метод лечения, позволяющий «протезировать» поврежденные клетки, — терапия с применением оксида азота (II) NO, являющегося газовым медиатором и выполняющего множество важных функций в организме (нейромедиатора, вазодилататора, антиагреганта, мощного фактора гомеостаза), в том числе играющего важнеейшую роль в процессах микроциркуляции. Группой ученых — ядерных физиков из Саровского физико-технического института под руководством члена-корреспондента РАН профессора В. Д. Селемира — был разработан уникальный прибор электрохимический генератор оксида азота, позволяющий проводить лечение NO непосредственно у постели пациента. Эта методика была применена в Санкт-Петербурге в группе врачей-ученых под руководством академика Е. В. Шляхто для лечения тяжелых больных, которые находились на искусственной вентиляции легких и экстракорпоральной мембранной оксигенации. Были получены положительные результаты.
|
Потенциальные патогенетические механизмы постковидного легочного фиброза:
|
Итак, в легочном здоровье человека в результате воздействия вируса SARS-CoV-2 происходят глобальные бедственные изменения, разрушается вся структура легких: альвеолярная поверхность, капиллярная сеть, межинтерстициальная ткань, происходит перетрубация, в основе которой лежит состояние, называемое респираторным дистресс-синдромом, которому предшествует цитокиновый шторм. Дача больших доз кислорода в данном случае не является лекарством. Кислород выступает как средство, вызывающее токсическое повреждение биологических мембран за счет образования так называемых активных форм кислорода.
|
Факторы риска пост-COVID фиброзных изменений спустя 4 месяца Перспективное одноцентровое исследование 72 пациентов, нуждающихся в кислородной поддержке спустя 4 месяца после выздоровления, показало, что
|
Другой серьезной проблемой, возникающей у пациентов с COVID-19, является легочный фиброз. Прогрессирование постковидного легочного фиброза взаимосвязано с рядом факторов, к которым относятся
- пожилой возраст;
- тяжелая одышка или высокая частота дыхательных движений;
- сопутствующая артериальная гипертензия;
- госпитализация в отделение интенсивной терапии.
Об угрозе постковидного легочного фиброза свидетельствуют следующие лабораторные данные:
- высокий уровень С-реактивного белка (СРБ);
- лимфопения;
- повышение уровня D-димера;
- низкий уровень интерферона G и моноцитарного хемотаксического белка-3 (ММР-3);
- укорочение теломер [2].
Постковидный синдром — проблема чрезвычайно острая, до конца нами не осознанная, которая будет раскрываться в дальнейшем. Это проблема, при которой требуется разработка новых методов, расширяющих диапазон возможностей современной терапии и профилактики.
Литература
1. Walker M. Many Hospitalized COVID Patients Develop New Ailments Later [Electronic resource] // MedPage Today. 2021. March 31. URL: https://www.medpagetoday.com/infectiousdisease/covid19/91890 (accessed: 26.12.2022).
2. McGroder C. F., Zhang D., Choudhury M. A., Salvatore M. M. et al. Pulmonary fibrosis 4 months after COVID-19 is associated with severity of illness and blood leucocyte telomere length // Thorax. 2021. V. 76(12). P. 1242–1245. doi: 10.1136/thoraxjnl-2021-217031.
3. Варфоломеев С. Д., Панин А. А., Быков В. И., Цыбенова С. Б. с соавт. Кинетическая модель развития острой вирусной инфекции в организме человека. Критические условия, механизмы управления, «термогелиокс» // Известия РАН. Серия Химическая. 2020. № 6. С. 1179–1184.
4. Walker M. Sniffing Out Where Virus First Strikes in COVID-19 [Electronic resource] // MedPage Today. 2020. August 19. URL: https://www.medpagetoday.com/infectiousdisease/covid19/88148 (accessed: 26.12.2022).
5. John A. E., Joseph C., Jenkins G., Tatler A. L.COVID-19 and pulmonary fibrosis: A potential role for lung epithelial cells and fibroblasts // Immunological Reviews. 2021. V. 302(1). P. 228–240. doi: 10.1111/imr.12977.
6. Шогенова Л. В., Варфоломеев С. Д., Быков В. И., Цыбенова С. Б. с соавт. Влияние термической гелий-кислородной смеси на вирусную нагрузку при COVID-19 // Пульмонология. 2020. Т. 30. № 5. С. 533–543. doi: 10.18093/0869-0189-2020-30-5-533-543.
7. Ackermann M., Verleden S. E., Kuehnel M. et al. Pulmonary Vascular Endothelialitis, Thrombosis, and Angiogenesis in Covid-19 // The NEJM. 2020. N 383. P. 120–128. doi: 10.1056/NEJMoa2015432.
8. Бурячковская Л. И., Мелькумянц А. М., Ломакин Н. В., Антонова О. А., Ермишкин В. В. Повреждение сосудистого эндотелия и эритроцитов у больных COVID-19 // Consilium Medicum. 2021. Т. 23. №. 6. С. 469–476. doi: 0.26442/20751753.2021.6.200939.
9. Bull B. S., Kuhn I. N. The Production of Schistocytes by Fibrin Strands (A Scanning Electron Microscope Study) // Blood. V. 35(1). P. 104–111.
10. Ambardar S. R., Hightower S. L., Huprikar N. A. et al. Post-COVID-19 pulmonary fibrosis: novel sequelae of the current pandemic // J. Clin. Med. 2021. V. 10 (11). P. 2452. doi: 10.3390/jcm10112452.



